L'équipe « Dynamique Membranaire des Interactions Parasites-Hôtes » de l'Institut pour l'Avancée des Biosciences (IAB/CNRS/INSERM/Université Grenoble Alpes) a franchi une nouvelle étape dans la compréhension des mécanismes d'invasion de la cellule hôte par le parasite de la toxoplasmose, Toxoplasma gondii. Ces résultats sont publiés dans « Cell Host & Microbe ».
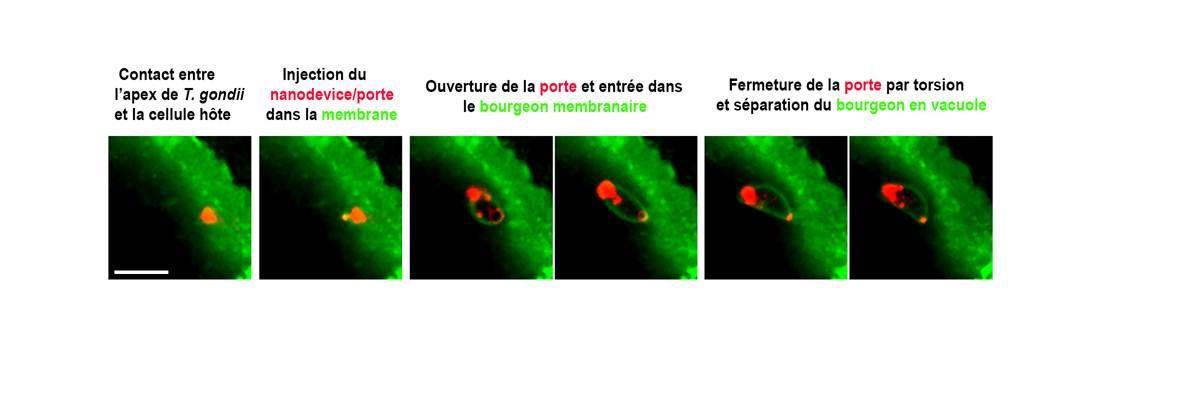
De précédentes études ont montré que T. gondii est capable d'injecter en 2 à 3 secondes dans la membrane de la cellule hôte un complexe protéique (appelé nanodispositif ou « nanodevice »). « Ce système lui permet d'ouvrir la membrane, comme il le ferait avec une porte », explique au « Quotidien » Isabelle Tardieux, une des auteurs de l'étude et directrice de recherche CNRS. « Notre équipe a montré précédemment que le parasite exerce ensuite une force de traction sur la porte pour l'ouvrir et se propulser à l'intérieur de la cellule au sein d’un bourgeon membranaire. Il s'agit donc d’un processus actif du parasite qui dépend d’un moteur actine-myosine fonctionnel parasitaire », ajoute-t-elle.
Isabelle Tardieux
Un mécanisme qui ne s'appuie par sur la machinerie cellulaire de l'hôte
Cette « porte », qui permet au parasite l’exploit d’envahir quasi n’importe quelle cellule de vertébré, doit être parfaitement refermée afin de préserver l'intégrité de la cellule qui protège et nourrit le parasite. C'est cette étape finale de l’invasion qui fait l'objet de cette étude. « Nous avons mis en évidence un mécanisme original, qui ne s'appuie pas sur la machinerie de fusion et de fission membranaire de la cellule hôte », souligne la chercheuse. Une fois le parasite à l'intérieur du bourgeon membranaire, il effectue une rotation sur sa base au contact de la porte. Cette torsion ou « twist » lui permet non seulement de refermer la porte et la membrane, mais aussi de se détacher de cette dernière par un clivage juste derrière la porte. Par ailleurs, grâce à la force de traction exercée, le bourgeon se transforme en une vacuole et lui sert de niche où se multiplier dans le cytoplasme de la cellule hôte.
Cette découverte a été possible grâce à une imagerie quantitative à haute vitesse du processus d’ouverture et de fermeture de la porte, mais aussi grâce à l'étude du mécanisme altéré. « En accrochant derrière le parasite des billes micrométriques, nous avons pu contrecarrer la capacité du parasite à fermer la porte et nous avons vu que cette incapacité était corrélée à l'absence de rotation », raconte Isabelle Tardieux. Lorsqu'il n'y a pas de rotation, la membrane ne se referme pas, ce qui entraîne un influx d'ions sodium dans le bourgeon et un dommage osmotique mortel pour le parasite. « Cette situation peut parfois se retrouver in vivo, lorsque les parasites ne parviennent pas à s’individualiser et restent appariés par leur pôle postérieur. Là, c’est le partenaire inactif qui remplace la bille », précise la chercheuse.
Le parasite pénètre dans la cellule en 10 à 20 secondes
« Ce parasite a inventé un mécanisme exceptionnel qui lui permet d'entrer dans toute cellule vertébrée nucléée en 10 à 20 secondes, sans altérer la membrane, un record de vitesse et d’efficacité », s'enthousiasme Isabelle Tardieux. « Mais il reste encore beaucoup d'inconnues, notamment concernant les propriétés élastiques de cette porte, la capacité des cellules de l'hôte à supporter un tel mécanisme et les signaux auxquels répond le nanodevice », note-t-elle. « Autant de questions auxquelles nous répondons en partenariat avec nos collègues parasitologues de l’IAB et les physiciens du laboratoire de Physique Interdisciplinaire de Grenoble ».
Outre l’aspect fondamental sur les propriétés des membranes, la compréhension de ces mécanismes pourrait à long terme ouvrir la voie à des pistes thérapeutiques, voire vaccinales applicables à d’autres parasites cousins proches du parasite de la toxoplasmose, comme l’agent du paludisme.
Photos : Isabelle Tardieux


Un 48e système de groupe sanguin découvert : les coulisses de la recherche
Neutropénie sous clozapine : des experts abaissent le seuil pour interrompre le traitement
Booster la recherche en santé passe par donner aux médecins les moyens d’en faire
Le ministère lance une stratégie nationale « Intelligence artificielle et données de santé »