La dorsalgie inflammatoire, à l’origine de l’hospitalisation du patient, évolue depuis plusieurs semaines, avec aggravation progressive et irradiation dans les membres supérieurs. Le patient de 50 ans a pour antécédent notable une leucémie aiguë myéloïde de type 4 considérée en rémission, traitée par chimiothérapie et allogreffe de cellule souche une année auparavant, compliquée de GVH (greffon versus hôte) non sévère.
Lors de l’examen physique initial, l’attention est attirée par des réflexes tendineux vifs sans signe de Babinski ni déficit sensitivo-moteur.
À la biologie, la protéine C réactive est un peu augmentée à 30 mg/L et la numération globulaire sans anomalie.
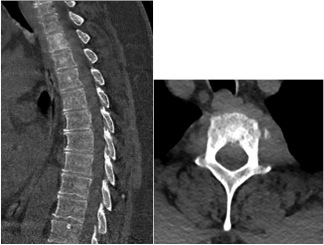
Dans ce contexte, une IRM du rachis dorsal est réalisée rapidement. On observe une masse de T2 associée à une extension épidurale allant de T1 à T3 refoulant le cordon médullaire, toutes deux en hyposignal T1 et T2 avec prise de gadolinium homogène de la lésion épidurale (Figure 1 ci-dessus). Sur le scanner réalisé en complément, on constate un aspect légèrement condensé de T2, sans lésion ostéolytique (Figure 2).
Un myélogramme est réalisé et ne retrouve aucune anomalie.
Le patient se dégrade malheureusement rapidement sur le plan neurologique, avec nécessité de faire en urgence une laminectomie C7-T3 en urgence. La biopsie réalisée en peropératoire retrouve alors une prolifération blastique au sein de la masse épidurale (Figure 3).

Le diagnostic finalement retenu est donc celui de chlorome et témoigne d’une rechute extra-médullaire post-allogreffe de la leucémie aiguë myéloïde. La biologie moléculaire identifie par ailleurs la réapparition d’une maladie résiduelle sanguine allant dans le même sens d’une progression de l’hémopathie.
L’évolution neurologique sera malheureusement défavorable et la lésion traitée par radiothérapie.
Le chlorome, une tumeur rare
Le chlorome (ou sarcome myéloïde) est une tumeur rare, composée de blastes myéloïdes extra-médullaires1. La présentation initiale peut comporter une tumeur unique ou des lésions multiples. De nombreuses localisations ont été décrites (os, système nerveux central, digestif, musculaire…). Au niveau du rachis, on observe principalement des lésions osseuses et/ou épidurales. La présentation clinique est alors celle d’une rachialgie inflammatoire plus ou moins associée à des signes neurologiques en rapport avec l’expansion de la masse.
Le contexte est souvent évocateur, ces tumeurs s’observant principalement en cas de rechute de leucémie aiguë myéloïde (principalement celles à différenciation monocytaire) ou d’acutisation d’une hémopathie à risque sous-jacente (notamment la leucémie myéloïde chronique et les syndromes myélodysplasiques). Toutefois, le chlorome peut apparaître initialement isolé, sans manifestation médullaire, rendant alors le diagnostic complexe. La durée médiane d’évolution vers une authentique leucémie est alors de 12 mois2.
L’examen anatomopathologique est la référence pour le diagnostic et les analyses immunohistochimiques sont bien souvent décisives.
Concernant l’imagerie, le scanner retrouve le plus souvent une lésion lytique ou mixte (ostéocondensante et lytique) mais peut se révéler sans anomalie. L’IRM est l’examen de choix et révèle une masse homogène en isosignal T1 et T2 (on peut toutefois retrouver un hypersignal T2 modéré) avec une forte prise de contraste homogène après injection de gadolinium3. La dissociation entre une atteinte scanographique modérée et l’importance des lésions en IRM, associé à l’isosignal T2, est évocatrice.
Le pronostic des chloromes rejoint celui de l’hémopathie sous-jacente. Son traitement, non codifié du fait de sa rareté, comporte le plus souvent de la radiothérapie et de la chimiothérapie. L’allogreffe est proposée par certains auteurs, y compris en cas de lésion unique sans atteinte médullaire initiale4.
Service de rhumatologie, Hôpital Lariboisière
(1) Almond LM, Charalampakis M, Ford SJ, et al. Myeloid Sarcoma: Presentation, Diagnosis, and Treatment. Clinical Lymphoma Myeloma and Leukemia 2017; 17:263–7
(2) Yamauchi K, Yasuda M. Comparison in treatments of nonleukemic granulocytic sarcoma: Report of two cases and a review of 72 cases in the literature. Cancer 2002; 94:1739–46
(3) Singh A, Kumar P, Chandrashekhara SH, Kumar A. Unravelling chloroma: review of imaging findings. BJR 2017; 90:20160710
(4) Chevallier P, Labopin M, Cornelissen J, et al. Allogeneic hematopoietic stem cell transplantation for isolated and leukemic myeloid sarcoma in adults: a report from the Acute Leukemia Working Party of the European group for Blood and Marrow Transplantation. Haematologica 2011; 96:1391–4.


CCAM technique : des trous dans la raquette des revalorisations
Dr Patrick Gasser (Avenir Spé) : « Mon but n’est pas de m’opposer à mes collègues médecins généralistes »
Congrès de la SNFMI 2024 : la médecine interne à la loupe
La nouvelle convention médicale publiée au Journal officiel, le G à 30 euros le 22 décembre 2024