Cataracte
La cataracte est la principale cause de malvoyance dans le monde. Son traitement chirurgical est la première chirurgie en fréquence réalisée dans le monde et notamment en France, avec plus de 603 000 Français opérés en 2009. L’endophtalmie postopératoire suite à l’implantation d’une lentille intraoculaire ou implant intraoculaire (« IOL » en anglo-saxon pour « IntraOcular Lens ») est une des complications les plus redoutables et redoutées de la chirurgie de la cataracte. Elle peut être responsable de la perte fonctionnelle voire anatomique de l’œil, sans compter le risque médico-légal associé (1).
Définition
Le terme endophtalmie signifie infection intraoculaire. L’endophtalmie peut être d’origine exogène (postopératoire ou post-traumatique) ou plus rarement endogène. Les micro-organismes en cause peuvent correspondre à des bactéries, des champignons, des virus, des protozoaires et des helminthes. L’endophtalmie postopératoire, sujet de cet article, est aiguë lorsqu’elle apparaît au cours des 6 premières semaines postopératoires, par opposition à l’endophtalmie chronique (2). Nous limiterons notre sujet à l’endophtalmie postopératoire aiguë.
De plus, les C.CLIN (Centre de Coordination de la Lutte contre les Infections Nosocomiales) définissent qu’une infection postopératoire est nosocomiale si par définition elle intervient dans les trente jours suivant l’intervention ou dans l’année suivant l’acte chirurgical en cas de mise en place d’un implant ou d’une prothèse (définition du Conseil Supérieur d’Hygiène Publique de France). Ainsi, toute endophtalmie chez le pseudophake (opéré de la cataracte) est considérée comme d’origine nosocomiale, ce qui a bien évidemment une connotation et une répercussion juridiques différentes (notion de responsabilité sans faute).
Épidémiologie
La fréquence de l’endophtalmie, qui était de 10 % au début du siècle, a diminué au cours du temps, et est estimée actuellement entre 0,05 % et 0,35 % des chirurgies réglées de la cataracte (3-7). Une meilleure maîtrise des règles d’asepsie et d’antisepsie, ainsi que l’amélioration des techniques opératoires avec le passage de la chirurgie intracapsulaire à la chirurgie extracapsulaire, en sont probablement les deux principales explications. En revanche, malgré l’introduction de la phacoémulsification, le taux d’endophtalmie postopératoire semble rester stable (8). Les modifications techniques liées à la phacoémulsification, avec des incisions plus petites mais parfois non suturées, avec des sites d’incision plus sûrs ou au contraire plus à risque, et ce pour des arguments réfractifs, semblent s’équilibrer du point de vue infectieux, leur impact sur le taux d’endophtalmie restant encore controversé.
Signes cliniques
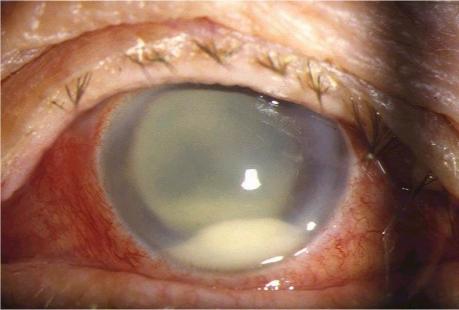
Les signes cliniques de l’endophtalmie aiguë doivent être parfaitement connus car l’endophtalmie est une urgence thérapeutique médicochirurgicale. Cinq signes d’alerte sont de grande valeur, même s’ils ne sont pas constamment retrouvés : une baisse d’acuité visuelle, une douleur, un cercle périkératique (rougeur conjonctivale prédominante autour de la cornée), un œdème palpébral et une photophobie. Un patient opéré d’une cataracte non compliquée ne doit jamais se plaindre de douleur dans la période postopératoire sauf s’il existe des complications notamment infectieuses. Au cours de l’étude internationale de référence (2), la douleur était présente initialement dans 74 % des cas, la rougeur oculaire dans 82 % des cas et la baisse d’acuité visuelle dans 94 % des cas. Il est intéressant de noter que la présence d’un diabète, malgré son éventuelle neuropathie associée, ne semble pas affecter la fréquence de la douleur. L’hypopion (niveau de pus en chambre antérieure) est présent dans 86 % des cas (Figure 1). Il n’est pas pathognomonique de l’endophtalmie mais reste un signe clinique fréquent de valeur, ainsi que la perte du reflet rétinien rougeâtre (67 % des cas).
Écologie bactérienne de l’œil
La source d’infection présumée est principalement la surface oculaire et ses annexes. Cela explique pourquoi les micro-organismes retrouvés dans les endophtalmies sont principalement des cocci gram positif (90 %), notamment les staphylocoques coagulase négatif (60 %) (9).
Traitement préventif
L’asepsie est l’ensemble des moyens qui permettent de diminuer la contamination des germes de façon non spécifique [prédésinfection (trempage, rinçage), nettoyage, stérilisation]. On doit s’acharner à contrôler les locaux (salle d’opération située en secteur aseptique, aménagement des entrées et sorties des blocs opératoires par rapport à la circulation du malade et de l’équipe soignante, contrôle de l’air et de l’eau, limitation des mouvements dans la salle d’opération et du nombre de visiteurs, tenir les portes fermées pendant l’intervention, interdire les déplacements et les conversations inutiles et l’entrée d’une personne porteuse d’une infection, notamment des voies aériennes…), le respect des procédures de qualité dans la stérilisation des instruments restérilisables, l’utilisation maximale des matériels à usage unique (canules, tubulures, champs non tissés, avec fenêtre plastique de type Op-site® ou Tégaderm® pour recouvrir les cils…).
L’antisepsie consiste en l’utilisation de substances toxiques pour les micro-organismes. Son objectif dans la chirurgie de la cataracte est de diminuer la quantité de bactéries autour de l’œil, pour éviter au maximum leur pénétration intracamérulaire (dans la chambre antérieure). Les patients doivent prendre une douche avec shampooing le matin de la chirurgie. Si possible, on conseille de la prendre aussi la veille au soir. De même, la Bétadine® (povidone iodée) scrub est préférée au gel douche et au shampooing habituel. Avant toute chirurgie intraoculaire, tous les patients bénéficient d’une phase de détersion/antisepsie et d’une phase d’antisepsie.
L’antibioprophylaxie a pour but de tuer les bactéries introduites dans l’œil lors de l’acte opératoire ou d’inhiber leur croissance. Elle était jusqu’à maintenant controversée en ophtalmologie, car son efficacité dans la chirurgie de la cataracte n’avait jamais été démontrée. La voie intraoculaire peropératoire était jusqu’à présent tombée en désuétude. La grande étude prospective comparative, randomisée, semi-ouverte, multicentrique européenne, qui s’est déroulée de septembre 2003 à janvier 2006, commence déjà à modifier nos pratiques (6). Les résultats démontrent que le taux total d’endophtalmies dans le groupe des patients ayant reçu 1 mg de céfuroxime en chambre antérieure en fin de chirurgie est nettement moins élevé que celui des patients n’ayant pas eu de céfuroxime : 0,06 % vs 0,30 % avec un odds-ratio à 4,92. Le céfuroxime est déjà utilisé en Suède depuis 1996 à titre systématique au cours des chirurgies de la cataracte. Une étude suédoise nationale prospective, menée entre 2002 et 2004 et rapportant toutes les chirurgies de la cataracte effectuées en Suède, a été publiée très récemment (7). Leur taux d’endophtalmie est de 0,048 %, avec comme facteur de risque majeur l’absence d’injection intracamérulaire de céfuroxime, confirmant les résultats de l’étude de l’ESCRS (European Society of Cataract and Refractive Surgery). En France, l’injection n’est pas réalisée chez les patients allergiques aux bêtalactamines.
Traitement curatif
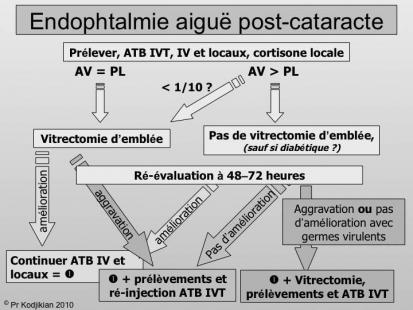
La conduite à tenir devant une endophtalmie postopératoire aiguë est la suivante : réaliser en urgence des prélèvements bactériologiques intraoculaires et pratiquer des injections intravitréennes (IVT) de 2 antibiotiques (voire de cortisone associée) dans les 2 heures.
Il faut également mettre en route une antibiothérapie systémique et topique (antibiotiques et corticothérapie) et enfin laisser à jeun le matin les jours suivants pour être prêt à réaliser une éventuelle vitrectomie en urgence (Figure 2). L’endophtalmie peut être considérée comme un abcès, c’est-à-dire du matériel purulent accumulé dans une cavité. À ce titre, l’évacuation chirurgicale semble tout à fait logique. Les buts de la vitrectomie sont multiples : diminuer la charge bactérienne, éliminer les toxines bactériennes, améliorer la diffusion des antibiotiques, éviter l’organisation secondaire du vitré et enfin réaliser des prélèvements bactériologiques purs non dilués.
Une étude observationnelle très récente vient d’être publiée concernant les pratiques des ophtalmologistes français (9).
Conclusion
Le diagnostic précoce de l’endophtalmie reste indispensable afin de pouvoir traiter en urgence et ainsi améliorer au maximum son pronostic fonctionnel. Il passe par l’information postopératoire des patients, avec remise d’un document écrit, et le suivi précoce au cours des premiers jours postopératoires. Tout œil rouge, douloureux avec baisse d’acuité visuelle en postopératoire précoce doit faire évoquer l’endophtalmie jusqu’à preuve du contraire. Le traitement préventif consiste en une asepsie et une antisepsie par Bétadine®. L’antibioprophylaxie par injection intracamérulaire de céfuroxime est utilisée de façon croissante en fin de chirurgie de la cataracte. Le traitement curatif consiste à prélever et au minimum à injecter des antibiotiques dans le vitré.
Bibliographie
1. Kodjikian L, Roques C, Baillif S, Pellon G, Hartmann D, Freney J, Burillon C. . J Fr Ophtalmol. 2 005 ; 28 : 1 122-30.
2. Results of the Endophthalmitis Vitrectomy Study. A randomized trial of immediate vitrectomy and of intravenous antibiotics for the treatment of postoperative bacterial endophthalmitis. Endophthalmitis Vitrectomy Study Group. Arch Ophthalmol 1 995;113:1 479-96.
3. Aaberg TM, Jr., Flynn HW, Jr., Schiffman J, Newton J. Nosocomial acute-onset postoperative endophthalmitis survey. A 10-year review of incidence and outcomes. Ophthalmology 1 998;105:1 004-10.
4. Salvanet-Bouccara A, Forestier F, Coscas G, Adenis JP, Denis F. [Bacterial endophthalmitis. Ophthalmological results of a national multicenter prospective survey]. J Fr Ophtalmol 1 992;15:669-78.
5. Kattan HM, Flynn HW, Jr., Pflugfelder SC, Robertson C, Forster RK. Nosocomial endophthalmitis survey. Current incidence of infection after intraocular surgery. Ophthalmology 1 991;98:227-38.
6. Prophylaxis of postoperative endophthalmitis following cataract surgery: Results of the ESCRS multicenter study and identification of risk factors. J Cataract Refract Surg 2 007;33:978-88.
7. Lundstrom M, Wejde G, Stenevi U, Thorburn W, Montan P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology 2 007 ;114:866-70.
8. Li J, Morlet N, Ng JQ, Semmens JB, Knuiman MW. Significant nonsurgical risk factors for endophthalmitis after cataract surgery: EPSWA fourth report. Invest Ophthalmol Vis Sci 2 004 ; 45:1 321-8.
9. Kodjikian L, Salvanet-Bouccara A, Grillon S, Forestier F, Seegmuller JL, Berdeaux G; French Collaborative Study Group on Endophthalmitis. Postcataract acute endophthalmitis in France: national prospective survey. J Cataract Refract Surg. 2009;35:89-97.

CCAM technique : des trous dans la raquette des revalorisations
Dr Patrick Gasser (Avenir Spé) : « Mon but n’est pas de m’opposer à mes collègues médecins généralistes »
Congrès de la SNFMI 2024 : la médecine interne à la loupe
La nouvelle convention médicale publiée au Journal officiel, le G à 30 euros le 22 décembre 2024